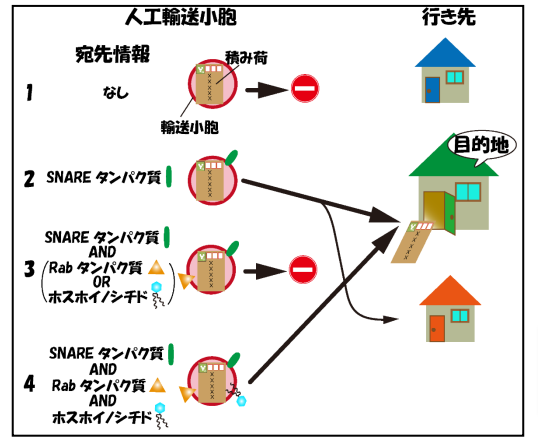
細胞内では無数の輸送小胞が盛んに行き来しており、オルガネラ間での物質輸送を担っている。私は輸送小胞がどのように正しい「行き先」(標的オルガネラ)を見つけるのかに興味を持って研究を行ってきた。既に分子生物学的手法を用いて膜輸送に関わる多くの因子が同定されているが、これらの情報だけでは「宛先」情報の十分条件を明らかにすることは出来なかった。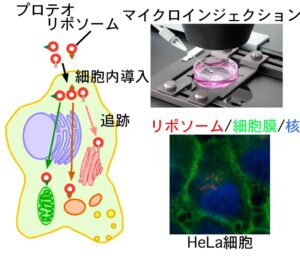 そこでリポソームを用いて特異的なターゲティング機構を備えた人工輸送小胞を作成することでこの問題に挑戦した。それまでにオルガネラやリポソームなどの超分子複合体を細胞内に効率的に導入する方法が確立されていなかったことから、まずこれら超分子複合体をマイクロインジェクションによって低侵襲に細胞内に導入する方法を確立した。この方法を用いて細胞外で作成した人工輸送小胞を細胞内に導入することで、細胞内で輸送小胞が正しいターゲット(オルガネラ)まで運ばれて行くための必要最小因子の同定を行なった。その結果、リポソーム膜上に特定のSANREタンパク質があれば、そのリポソームが細胞内に導入された後、特定のオルガネラへのみ運ばれること、更にオルガネラ膜上に存在する「係留因子」が目的のSANREを持つ小胞を捕獲することが、SNARE依存的な小胞輸送の特異性を決定していることがわかった。これまで、SNAREタンパク質は膜融合の過程で働くと理解されてきたが、係留過程でも重要な役割を担っていることを初めて明らかにすることができた。この成果は、輸送小胞が持つ「行き先」の必要十分条件を初めて明らかにしたものであり、今後輸送小胞の行先を人工的にコントロールするために非常に重要な知見である。現在は、オルガネラ膜に存在し特異的SNAREタンパク質と結合する新規係留因子の同定を試みている。すでに、Vps13Bを同定しており、現在はその詳細な機能について調べている。
そこでリポソームを用いて特異的なターゲティング機構を備えた人工輸送小胞を作成することでこの問題に挑戦した。それまでにオルガネラやリポソームなどの超分子複合体を細胞内に効率的に導入する方法が確立されていなかったことから、まずこれら超分子複合体をマイクロインジェクションによって低侵襲に細胞内に導入する方法を確立した。この方法を用いて細胞外で作成した人工輸送小胞を細胞内に導入することで、細胞内で輸送小胞が正しいターゲット(オルガネラ)まで運ばれて行くための必要最小因子の同定を行なった。その結果、リポソーム膜上に特定のSANREタンパク質があれば、そのリポソームが細胞内に導入された後、特定のオルガネラへのみ運ばれること、更にオルガネラ膜上に存在する「係留因子」が目的のSANREを持つ小胞を捕獲することが、SNARE依存的な小胞輸送の特異性を決定していることがわかった。これまで、SNAREタンパク質は膜融合の過程で働くと理解されてきたが、係留過程でも重要な役割を担っていることを初めて明らかにすることができた。この成果は、輸送小胞が持つ「行き先」の必要十分条件を初めて明らかにしたものであり、今後輸送小胞の行先を人工的にコントロールするために非常に重要な知見である。現在は、オルガネラ膜に存在し特異的SNAREタンパク質と結合する新規係留因子の同定を試みている。すでに、Vps13Bを同定しており、現在はその詳細な機能について調べている。
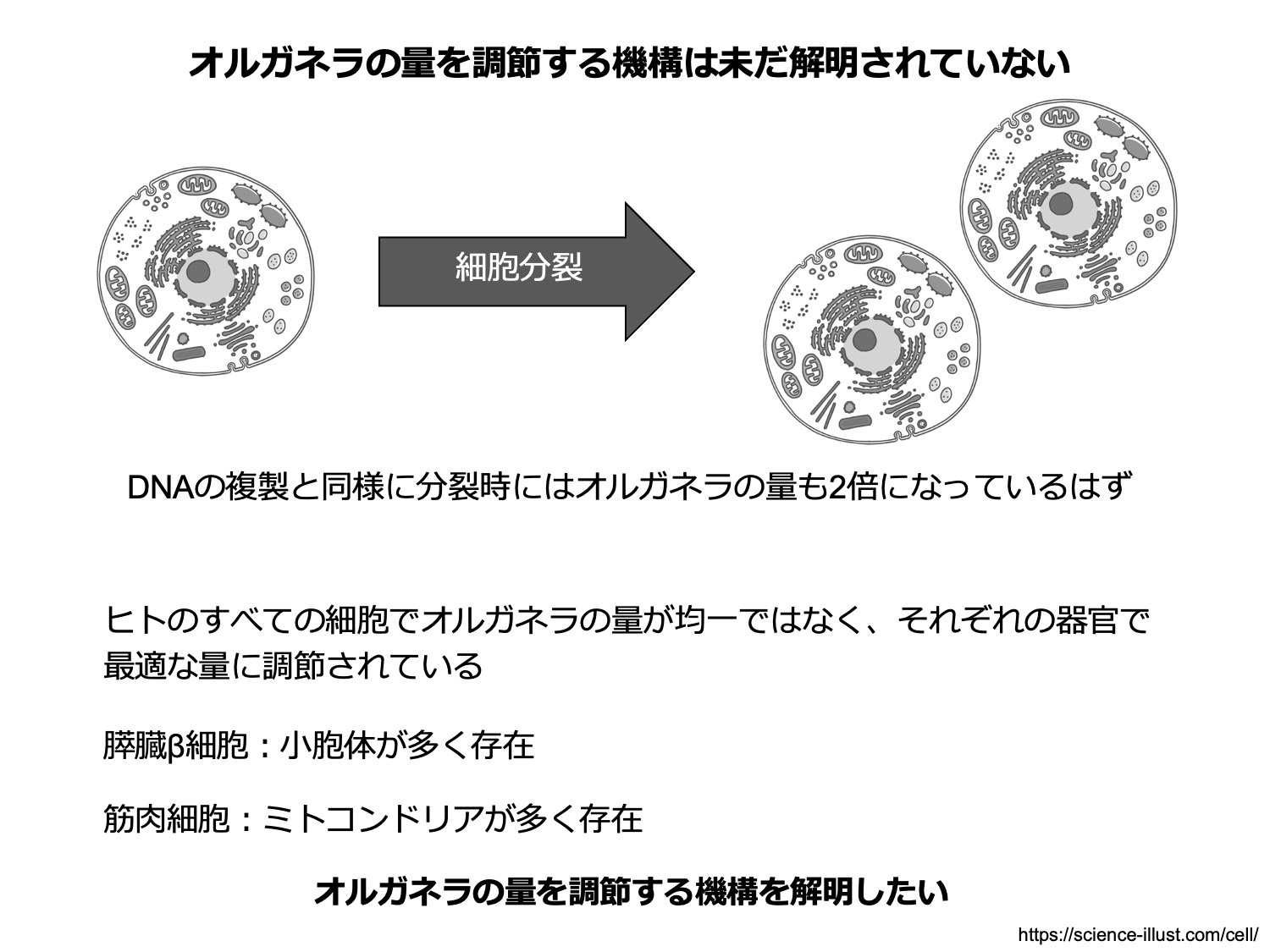 1つの細胞が分裂し2つの娘細胞ができてもオルガネラの配置、数はほとんど同じである。このことは、細胞はオルガネラの数や位置を厳密に制御していることを意味している。これまでのアプローチのみでは、オルガネラの「量」を意図的に変化させることは難しく、細胞がオルガネラの量を制御するメカニズムや、その生理的意義は明らかになっていない。そこで、オルガネラの量を人為的に変化させるシステムを開発することで、オルガネラ量を感知するセンサー機構の解明とその生理的意義を明らかにすることを目指している。
1つの細胞が分裂し2つの娘細胞ができてもオルガネラの配置、数はほとんど同じである。このことは、細胞はオルガネラの数や位置を厳密に制御していることを意味している。これまでのアプローチのみでは、オルガネラの「量」を意図的に変化させることは難しく、細胞がオルガネラの量を制御するメカニズムや、その生理的意義は明らかになっていない。そこで、オルガネラの量を人為的に変化させるシステムを開発することで、オルガネラ量を感知するセンサー機構の解明とその生理的意義を明らかにすることを目指している。
細胞やオルガネラに興味もってくれた人!何か新しいものを創りたい人!とにかく実験してみたい人!どんな人でもOKです。 大学1年生、2年生も実験やってます。 修士課程、博士課程の学生さんも募集中! とりあえず、 メールアドレス: skoike『あっと』eng.u-toyama.ac.jp (『あっと』を@に変換) まで気軽に連絡下さい お待ちしています。

小池 誠一講師
略歴
平成18年4月 筑波大学大学院人間総合科学研究科 研究員
平成22年4月 Max Planck Institute for Biophysical Chemistry 研究員
(平成22年4月〜平成23年3月上原記念財団海外留学助成)
平成30年9月 東京大学大学院医学系研究科分子細胞生物学専攻 特任助教
令和2年4月 富山大学工学部工学科生命工学コース 特命助教
令和7年4月 富山大学工学部工学科生命工学コース 講師
現在に至る
学位・資格等
博士(医学)
専門分野
細胞生物学、合成細胞生物学、生殖医学
他メンバー
博士課程2年 1名
修士課程1年 1名
学部4年生 4名
技術補佐員 1名
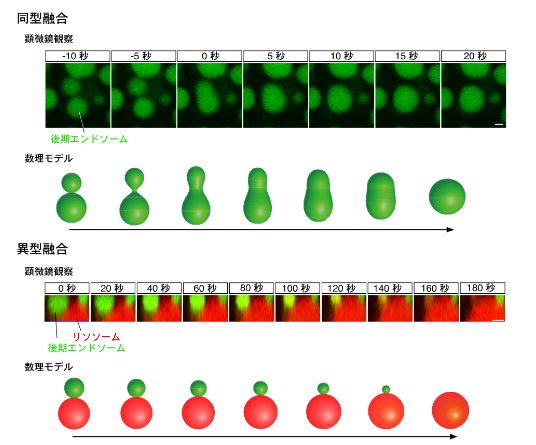
マウス胚を包む卵黄嚢の細胞を用いて、細胞内で物質の輸送などを行う小胞を蛍光物質で標識し、これが融合する過程を可視化する技術を開発しました。これにより小胞の融合過程を観察したところ、融合には2つの異なる様式があること、また、その制御に細胞骨格アクチンが関与することを見いだしました。
細胞は、外界から物質を取り込み、エンドソームと呼ばれる小胞に包んで細胞内を輸送します。輸送過程で、小胞は、小胞同士、あるいは他の細胞内小器官と融合しますが、多くの細胞ではそのサイズが小さいために融合過程を観察することが難しく、その制御機構はよく分かっていませんでした。
本研究では、マウス胚の一番外側にある臓側内胚葉細胞に着目し、蛍光物質でエンドソームを標識することにより、顕微鏡下でその融合過程を観察することに成功しました。これにより、エンドソームの融合には、2つのエンドソームが急速に融合して1つの小胞になる「同型融合」と、リソソームにゆっくりと吸収される「異型融合」の2種類の様式があることを見いだしました。膜の力学モデルを用いて小胞融合過程の数理解析を行ったところ、小胞のサイズが融合様式を決めており、小胞が小さい時は同型融合が、小胞が大きくなると異型融合が起こること、また、小胞の膜にゆらぎの力を作用させると、大きなサイズでも同型融合が起こることが分かりました。エンドソームにはアクチンと呼ばれる細胞骨格タンパク質が結合しており、アクチンが同型融合を促進するゆらぎの力を発生させていると考えられました。さらに、アクチンのターンオーバーを促進するコフィリンや、アクチンと相互作用するミオシンも小胞融合に重要であることが明らかになりました。この観察系を用いることにより、細胞内小胞の融合や輸送の過程を制御する仕組みを解明できると期待されます。
https://research-er.jp/articles/view/132476