


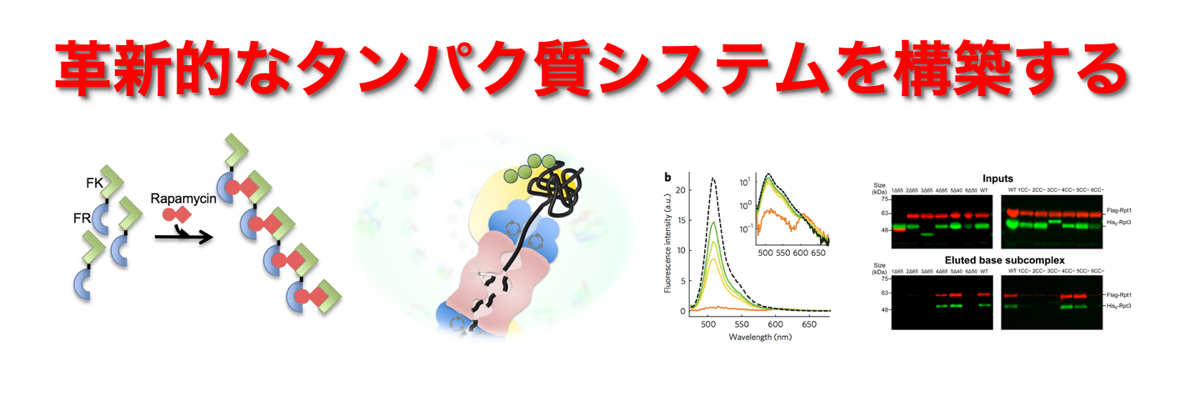
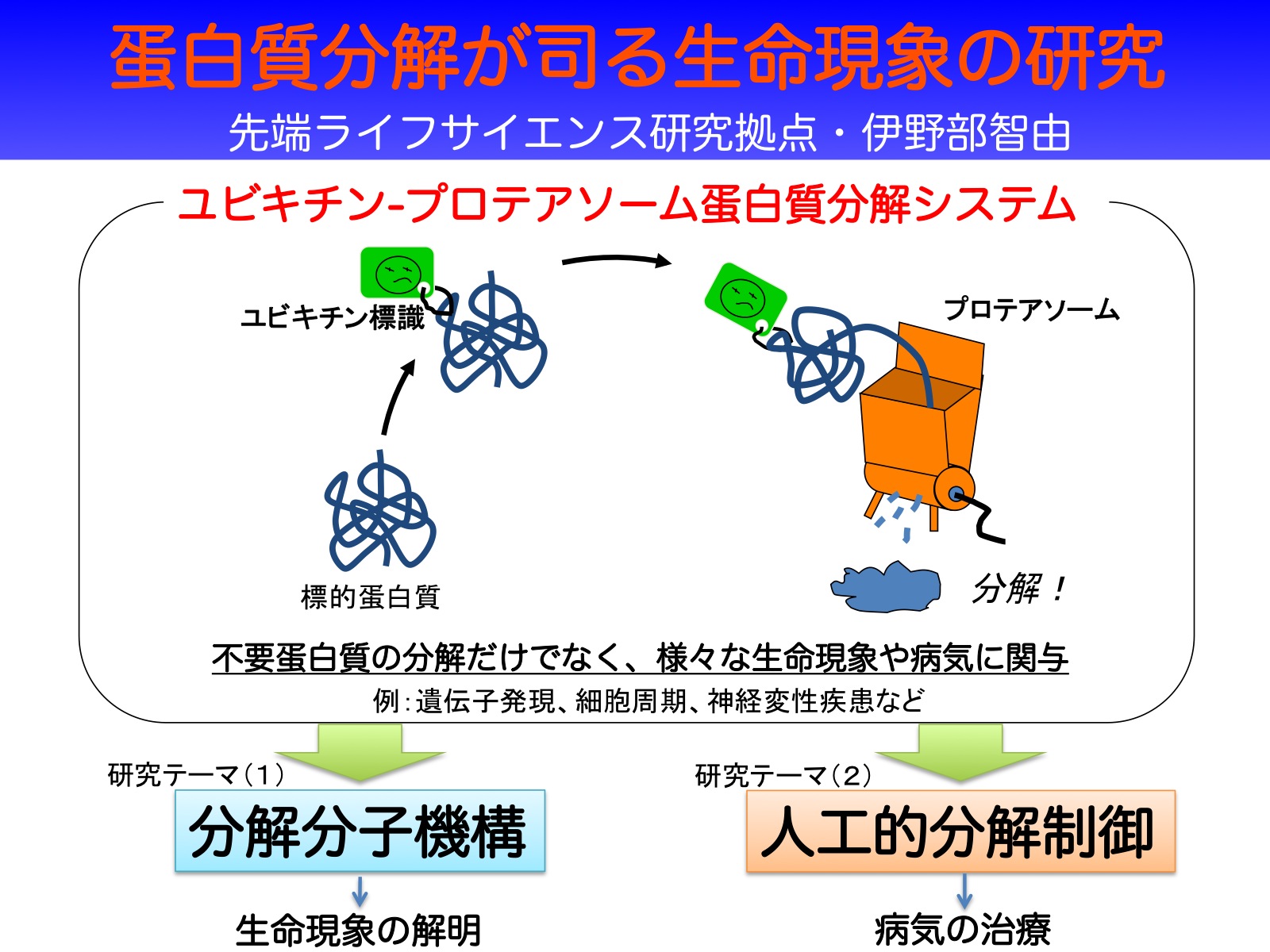
生命活動の主役を担うタンパク質の量は、合成のみならず、時と場合に応じた分解によっても制御されています。そのためタンパク質の分解異常は、ガンや神経変性疾患など多くの疾患の発症をもたらします。ユビキチン−プロテアソーム系(UPS)は細胞内の重要なタンパク質分解機構であり、不要とされるタンパク質にポリユビキチン鎖を付加し、これを目印としてプロテアソームでの選択的な分解を行うと考えられてきました。我々は、この分解機構による効率的分解にはポリユビキチン鎖の付加だけでは不十分で、分解の標的となるタンパク質自身にフラフラとしたUnstructured領域が必要であることを明らかにしました。これらの成果はポリユビキチン鎖ではなく、Unstructured領域がタンパク質の最終的な運命を決めていることを示しています。我々は、Unstructured領域を介したプロテアソームによるタンパク質分解の分子メカニズムを解き明かした上で、Unstructured領域に着目した分解の人工制御方法の開発を目指しています。
1.Unstructured領域を介したプロテアソームによるタンパク質分解の仕組み
我々は、UPSによるタンパク質分解にはポリユビキチン鎖をシグナルとするプロテアソームへの運び込みだけでは不十分で、標的蛋白質自身にアンフォールド・分解の起点となるUnstructured領域が必要であると提唱しています(図1)(Inobe & Matouschek (2014) Curr. Opin. Struct. Biol.)。我々は、以下の研究でこの仮説を証明し、効率的な分解を引き起こすUnstructured領域の特徴を詳細に調べ上げました。
Unstructured領域がある程度以上の長さを持ち、ユビキチンタグから適度な距離にあるときにのみ、効率的な分解が起こる。ユビキチンタグから近すぎても遠すぎても、分解を引き起こすことが出来ない。この配置依存性はポリユビキチン鎖とユビキチン様ドメインの間で異なる。Unstructured領域の位置や配置は、プロテアソームが分解する蛋白質を選ぶにあたり、重要な役割を担っていると考えられる(図1)(論文1)。
Unstructured領域アミノ酸配列の多くの物理化学的性質は、分解の受けやすさと相関はないが、配列の複雑度は分解の受けやすさと相関がある。つまり複雑なアミノ酸配列から構成されるUnstructured領域をもつ蛋白質だけが、プロテアソームによって分解される(図1)。酵母の生育に必須なE2酵素Cdc34など細胞内の多くの蛋白質も、このルールに従い分解のされやすさが決まっている(論文2)。
ポリユビキチンタグとUnstructured領域がタンパク質複合体中の2つの別のポリペプチド鎖に分離された場合、プロテアソームはUnstructured領域を持ったサプユニットだけ特異的に分解し、ポリユビキチンタグをもつサブユニットは分解を免れることができる。(図2C参照)(Prakash, Inobe et al.(2009) Nature Chem. Biol.)。
以上の成果は、Unstructured領域がタンパク質の最終的な運命を決めていることを示しています。
2.Unstructured領域をターゲットにした分解の制御
我々は分解の最終決定因子であるUnstructured領域のプロテアソームへのアクセスを加速させたり、阻害したりすることによって、標的タンパク質の特異的分解制御(分解誘導と分解抑制)が可能になる技術の開発を行い、以下のような成果をあげている(図2)。
標的タンパク質のUnstructured領域の性質をリガンド結合や修飾などにより変化させれば、標的タンパク質のプロテアソームによる分解を抑制できることを示した(図2A)(論文3)。この発見を踏まえ、Unstructured領域結合抗体による、より汎用的な標的タンパク質選択的な分解阻害方法の開発を行っている(未発表)。
プロテアソームATPaseリングから飛び出たCoiled-coil突起構造は、ATPaseリングの構造を保つためだけでなく、標的タンパク質のUnstructured領域認識に関与していることを明らかにした(論文4)。そしてこのCoiled-coil領域をミミックするペプチドは、本来のCoiled-coil構造を乱し、プロテアソームを阻害すると報告した(図2B)(Inobe & Genmei (2015) Biochem. Biophys. Res. Commun.)。
上記のサブユニット特異的な分解の研究成果を踏まえ、標的タンパク質の分解を誘導するアダプタータンパク質を開発した(図2C)。標的タンパク質を特異的に認識する小型抗体と、プロテアソーム結合標識を融合したアダプタータンパク質は、標的タンパク質をプロテアソームに運び込み、その分解を誘導することを示した(未発表)。
変異導入によりUnstructured領域を露出しやすい不安定化ユビキチンは、プロテアソームにより分解されやすい(論文5)。これを踏まえ開発した分解誘導性Unstructured領域融合ユビキチンは、標的タンパク質をポリユビキチン化し、その迅速な分解を誘導することを示した(図2D)(投稿中)。
以上で開発した分解制御方法を応用し、特定タンパク質の分解異常が原因となる病気(癌や神経変性疾患など)の新規治療法の確立に挑んでいます。

伊野部 智由准教授
Tomonao INOBE, Associate Professor
略歴
学歴
研究歴
学位・資格等
専門分野
タンパク質科学、生物物理学
主な業績
プロフィール
受賞
総説
紀要等
招待講演
国際学会発表
2019年5月23日
平成31年度富山第一銀行奨学財団「研究活動に対する助成」に採択されました。
2019年4月1日
科学研究費補助金 基盤研究(C)に採択されました。
「プロテアソームによる分解のための基質蛋白質内包性分解シグナルの解明」(代表:伊野部智由)
2019年3月26日
日本生物物理学会 中部支部講演会(岡崎)でM1 大沼幸平君が口頭発表し、最優秀発表賞を受賞しました。
2019年3月13日
田村科学技術振興財団の平成30年度下期助成に採択されました。
2019年1月24日
本研究室の取り組む研究が、国立大学協会のホームページで紹介されました
2018年11月15〜17日
韓国・ソウルで開催されたThe 18th KIAS Conference on “Protein Structure and Function”で伊野部が招待講演を行いました。
2018年8月26〜29日
International Symposium on “Proteins; from the Cradle to the Grave”で伊野部が発表しました。
2018年7月17日
伊野部が桜井高校にて模擬授業を行いました。
2018年6月12日
伊野部が共著者として加わった論文がScientific Reportsに採択されました。
Matsumoto, G., Inobe, T., Amano, T., Murai, K., Nukina, N. and Mori, N. (2018) N-Acyldopamine induces aggresome formation without proteasome inhibition and enhances protein aggregation via p62/SQSTM1 expression. Scientific Reports, 8, 9585.
2018年5月14日
Biochem Biophys Res Communに以下の論文が採択されました。
Inobe, T., Tsukamoto, M. and Nozaki, M. (2018) Proteasome-mediated protein degradation is enhanced by fusion ubiquitin with unstructured degron. Biochem. Biophys. Res. Commun., 501, 948-954.
2018年4月18日
日本応用酵素協会の2018年度酵素研究助成に採択されました。
2018年4月12日
高橋産業経済研究財団の平成30年度研究助成金に採択されました。
2018年4月1日
科学研究費補助金 新学術領域研究(研究領域提案型)に採択されました。
「細胞夾雑系における選択的タンパク質分解制御方法の開発」(代表:伊野部智由)
2017年11月10日
新学術領域研究「新生鎖の生物学」班会議で伊野部が発表しました。
2017年6月17日
北日本放送(KNB)「こんにちは富山県です」で、とやま賞 の受賞内容が紹介されました(アーカイブ)。
2017年4月22日
富山県ひとづくり財団の第34回「とやま賞」を受賞しました(北日本新聞4月22日)。
2017年4月3日
高橋産業経済研究財団の平成29年度研究助成金に採択されました。
2017年4月1日
科学研究費補助金 新学術領域研究(研究領域提案型)に採択されました。
「新生鎖分解のUnstructured領域を介した多層的制御機構」(代表:伊野部智由)
2016年11月26日
第54回日本生物物理学会年会において「蛋白質の秩序化−脱秩序化研究の最前線」と題したシンポジウムを開催し、伊野部も講演しました。
Tomonao Inobe, "Regulation of proteasomal degradation"
2016年9月21日
伊野部研究室で博士研究員を募集しています。
2016年9月16日
金原一郎記念医学医療振興財団の第31回基礎医学医療研究助成金に採択されました。
2016年6月9日
第16回日本蛋白質科学会年会ワークショップで伊野部が講演しました。
伊野部智由、 "プロテアソームによる新生鎖の分解制御"
2016年5月17日
Journal of Biological Chemistryに伊野部の以下の共著論文が受理されました。
Yu, H., Singh Gautam AK., Wilmington, SR., Wylie, D., Martinez-Fonts, K., Kago, G., Warburton, M., Chavali, S., Inobe, T., Finkelstein, I., Babu, MM., and Matouschek, A. (2016) Conserved sequence preferences contribute to substrate recognition by the proteasome. J. Biol. Chem., doi:10.1074/jbc.M116.727578.
2016年4月29日
Scientific Reportsに伊野部の以下の共著論文が掲載されました。
Kurosawa, N., Wakata, Y., Inobe, T., Kitamura, H., Yoshioka, M., Matsuzawa, S., Kishi, Y., and Isobe, M. (2016) Novel method for the high-throughput production of phosphorylation site-specific monoclonal antibodies. Scientific Reports, 6, 25174.
2016年4月22日
平成28年度ほくぎん若手研究者助成金に採択されました(贈呈式)。
2016年4月1日
伊野部研究室は富山大学大学院 理工学研究部(工学)に異動しました。
2016年2月2日
Biochem Biophys Res Communに以下の論文が掲載されました。
Inobe, T. and Nozaki, M. (2016) Proteasomal degradation of damaged polyubiquitin. Biochem. Biophys. Res. Commun., 471, 34-40, doi:10.1016/j.bbrc.2016.02.006.
2015年12月3日
Journal of Bioscience and Bioengineeringに以下の論文が掲載されました。
Inobe, T. and Nukina, N. (2016) Rapamycin-induced oligomer formation system of FRB-FKBP fusion proteins. Journal of Bioscience and Bioengineering, 122, 40-46, doi: 10.1016/j.jbiosc.2015.12.004.
2015年10月27日
Biochem Biophys Res Communに以下の論文が掲載されました。
Inobe, T. and Genmei, R. (2015) Inhibition of the 26S proteasome by peptide mimics of the coiled-coil region of its ATPase subunits. Biochem. Biophys. Res. Commun., 468, 143-150, doi:10.1016/j.bbrc.2015.10.144
2015年9月30日
Biochem Biophys Res Communに以下の論文が掲載されました。
Inobe, T., Nozaki, M. and Nukina, N. (2015) Artificial regulation of p53 function by modulating its assembly. Biochem. Biophys. Res. Commun., 467, 322-327, doi: 10.1016/j.bbrc.2015.09.162
2015年8月17日
ACS Chemical Biologyに以下の論文が掲載されました。
Takahashi, K., Matouschek, A. and Inobe, T. (2015) Regulation of proteasomal degradation modulating an unstructured proteasomal initiation region of a substrate. ACS Chem. Biol., 10, 2537–2543, doi: 10.1021/acschembio.5b00554
2015年7月25日
PLoS ONEに以下の論文が掲載されました。
Inobe, T. and Genmei, R. (2015) N-terminal coiled-coil structure of ATPase subunits of 26S proteasome is crucial for proteasome function. PLoS ONE, 10(7): e0134056. doi: 10.1371/journal.pone.0134056
2015年4月1日
科学研究費補助金 新学術領域研究(研究領域提案型)に採択されました。「プロテアソームによる新生鎖分解の分子シャペロンによる制御」(代表:伊野部智由)
2015年2月2日
Nature Structural & Molecular Biologyに以下の論文が掲載されました。
Fishbain, S., Inobe, T., Israeli, E., Chavali, S., Yu, H., Zokarkar, A., Babu, MM., and Matouschek, A.(2015) Sequence composition of disordered regions fine-tunes protein half-life. Nature Struct. Mol. Biol., 22, 214-221
2014年12月11日
The 5th International Symposium on Life Science in Toyama -Protein and Cell Metabolism"で伊野部が発表しました。
Inobe, T. "Regulation of the proteasome-mediated protein degradation"
2014年11月17日
2014年12月11日にThe 5th International Symposium on Life Science in Toyama -Protein and Cell Metabolismが開催されます。
2014年10月27日
鈴木謙三記念医科学応用研究財団の平成26年度調査研究助成に採択されました。
2014年10月24日
ホクト生物科学振興財団の平成26年度研究奨励金に採択されました。
2014年4月10日
旭硝子財団の平成26年度研究奨励に採択されました。
2014年4月1日
科学研究費補助金 若手研究(B)に採択されました。
2014年3月14日
Current Opinion in Structural Biologyに伊野部の総説が掲載されました。
Inobe, T. and Matouschek A. (2014) Paradigms of protein degradation by the proteasome. Curr. Opin. Struct. Biol., 24, 156-164.
2014年1月31日
倉田記念科学技術財団の第46回倉田奨励金に採択されました。
2013年12月16日
第二回日本バイオマテリアル学会北陸若手研究発表会で伊野部が発表しました。
伊野部智由、 "Unstructured領域を介した蛋白質分解制御"
2013年10月28ー30日
第51回日本生物物理学会年会にて伊野部研のメンバーが発表しました。
高橋一暢、伊野部智由 "Regulation of proteasomal degradation through an unstructured initiation site of a substrate"
2013年10月3日
内藤記念科学振興財団の第45回内藤記念科学奨励金・研究助成に採択されました。
2013年7月9-12日
The 35th Naito Conference on "The Ubiquitin-Proteasome System: from basic mechanisms to pathophysiological roles "で伊野部が発表しました。
Inobe, T., Takahashi, K. and Matouschek A. "Regulation of proteasome-mediated degradation by regulating an unstructured initiation region"
2013年6月12ー14日
第13回日本蛋白質科学会年会にて伊野部研のメンバーが発表しました。
高橋一暢、伊野部智由 "変性領域を介したプロテアソームによる蛋白質分解の制御"
2013年3月22日
稲盛財団の平成25年度研究助成金に採択されました。
2013年2月19日
ノバルティス科学振興財団のノバルティス研究奨励金に採択されました。
2013年2月1日
第三回先端ライフサイエンスセミナーを開催し、Ashwini Patil博士(東大医科研ヒトゲノム解析センター)に講演していただきました。
Ashwini Patil "Computational methods for functional annotation of proteins"
2012年12月5-6日
The 6th International Symposium “Molecular Science of Fluctuations toward Biological Functionsで伊野部が発表しました。
Tomonao Inobe, Kazunobu Takahashi, and Andreas Matouschek "Fluctuation-mediated regulation of the protein degradation by the proteasome" (招待講演)
2012年11月14日
アステラス病態代謝研究会の研究助成に採択されました。
2012年10月4日
持田記念医学薬学振興財団の研究助成に採択されました。
2012年7月29日ー8月5日
FASEB Science Research Conference "Protein Folding in the Cell"(アメリカ・ヴァーモント州)で伊野部がポスター発表しました。
Tomonao Inobe, Kazunobu Takahashi, Andreas Matouschek, and Nobuyuki Nukina "Selective proteasomal degradation of the mutant huntingtin protein by an artificial adapter protein."
2012年7月4日
武田科学振興財団のライフサイエンス研究奨励に採択されました。
2012年6月20ー22日
第12回日本蛋白質科学会年会にて伊野部研のメンバーが発表しました。
伊野部智由、高橋一暢、Matouschek, Andreas、貫名信行 "人工アダプター蛋白質による変異ハンチンチンの選択的プロテアソーム分解"
高橋一暢、伊野部智由 "揺らぎのある変性領域を介したプロテアソームの基質認識"