


北アルプスの大自然に育まれた教育研究環境

限りない探求への道
遅発性アルツハイマー型認知症の発症機構の解明に向けて
アルツハイマー病(AD)は若年型と遅発型に大別され、大半は発症機構不明の遅発型である
日本を始めとする先進国では、高齢者人口の増加に伴う認知症患者の急増が大きな社会問題になりつつあります。認知症の発症原因を明らかできれば、治療法や予防法の開発に大きな貢献をもたらします。認知症の過半数はアルツハイマー型認知症によって占められ、その2%を構成する若年性アルツハイマー型認知症では、アミロイド前駆タンパク質遺伝子、プレセネリン1遺伝子ならびにプレセネリン2遺伝子の変異によって引き起こされることが証明されています。しかし残りの98%を占める遅発性アルツハイマー型認知症では、これらの遺伝子のいずれにも変異がないことから、その発症機構解明のため世界中で研究が行われています。しかし遅発型アルツハイマー型認知症では、弱い効果をもたらす複数の遺伝子の影響が重なり合うことで発症をもたらすと考えられ、その原因遺伝子や発症機構について未だほとんどわかっていません。
老化促進マウス(SAMP8)のゲノム解析による加齢に伴う記憶学習障害責任遺伝子の探索
われわれの研究室では、遺伝的に加齢に伴う認知症を起こすSAMP8マウスに着目し、受動的回避反応を指標とした量的形質連鎖解析(QTL)法という遺伝学的手法を用いてSAMP8マウスの認知症の発症に関わる遺伝子を探索しました。その結果、SAMP8マウスにおいて認知症の発症に関わる複数の遺伝子が変異していることを発見しました。非常に興味深いことに、これらの遺伝子はいずれもヒトの遅発性アルツハイマー型認知症の発症原因となり得る遺伝子でした。
アルツハイマー病とSAMP8由来変異型Serpina3n遺伝子との関連
ADの発症にはアミロイドβ42(Aβ42)という42個のアミノ酸残基からなるペプチドの沈着が関与しています。AD患者では老人斑と呼ばれる脳の病変部位にAβ42が沈着することで、神経細胞が変性し認知症をもたらすと考えられています。Aβ42にはペプチド生成直後から立体構造がどんどん変化する性質があります。老人斑に蓄積しているAβ42の大半は安定な繊維状の構造を持ち神経毒性はほとんどありません。それに対してその構造に至る中間段階にあるオリゴマーという構造を持つAβ42には強い神経毒性があります。脳脊髄液中にはα1-アンチキモトリプシン(SERPINA3)と呼ばれるタンパク質が多く含まれ、老人斑に大量に蓄積していることが知られていました。われわれはSAMP8ではSerina3nと呼ばれるマウス版のα1-アンチキモトリプシン遺伝子に変異が存在し、その変異型Serina3nタンパク質はAβ42と結合することでAβ42をオリゴマー状態に長く留め、神経毒性を長期間発揮させることを発見しました。さらに同様の性質をもたらす遺伝子多型がヒトにも存在し、Aβ42の神経毒性を増強させることも発見しました。また、これらの性質とは対照的に、Aβ42のコンフォメーション変化を加速させオリゴマーの状態を最小限に留めさせる性質をもつヒトSERPINA3の多形も見つけました。これらの発見はSERPINA3が、Aβ42の神経毒性を増強したり抑制したりする能力を持つことを示しており、新しい治療薬開発の標的分子となる可能性を示唆しています。
SAMP8ではアルツハイマー病との関連が示唆されるSlc24a4イオントランスポーターが変異によって機能不全を起こしている
遅発型アルツハイマー病の原因遺伝子を探索するため、正常人の集団とAD患者の集団間でゲノム中の多形が比較され、AD患者に偏って存在する多形がSLC24A4遺伝子のイントロン中に同定されています。しかしこの多形とAD発症との機能的因果関係は未だ明らかにされていません。われわれがSAMP8のQTL解析によって同定した遺伝子座には変異型のSlc24a4遺伝子が存在することを発見しました。Slc24a4遺伝子は3分子の細胞外Na+と、それぞれ1分子ずつのK+とCa2+との交換を行うNCKX3というイオントランスポーターをコードしています。この交換反応によって神経細胞は興奮によって上昇した細胞内Ca2+を速やかに下げることができます。SAMP8由来のSlc24a4では変異によるアミノ酸置換によってCa2+の交換能力が顕著に低下していることを発見しました。ADの発症には細胞内Ca2+濃度の上昇が関与しているとの仮説が長く信じられていますが、この結果は、Slc24a4の機能不全がどのように神経変性をもたらすかを研究するための良い動物モデルとなる可能性を示唆しています。
単一細胞由来高性能モノクローナル抗体迅速単離システムの開発
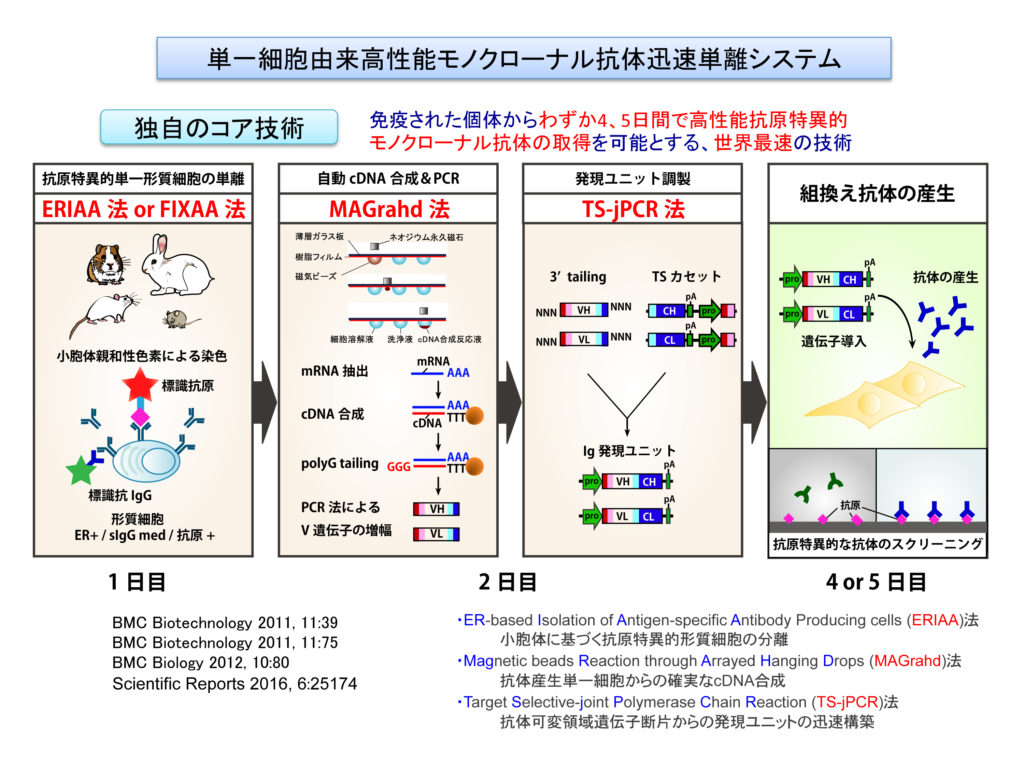
われわれは、免役された個体から目的の抗原と結合するモノクローナル抗体を最短4日間で取得できる世界最速かつ高効率な抗体取得システムの開発に成功しました。図に示すように、本システムは(1)セルソーターを用いた抗原特異的抗体産生単一細胞の分離、(2)懸垂液滴アレイ式磁気ビーズ反応(MAGrahd)法と命名した独自開発の手法による、多数の単一細胞からの5’RACE用cDNAの自動合成、(3)免疫グロブリン軽鎖ならびに重鎖可変領域遺伝子断片の増幅、(4)標的配列選択的連結PCR(TS-jPCR)法を用いた、一切の精製や大腸菌を介さない抗体可変領域遺伝子断片の抗体発現ユニットへの選択的組込み、(5)得られた発現ユニットの培養細胞への導入と発現というステップで構成され、わずか4、5日間の行程で抗原特異的な抗体を多数単離できるという特徴を有します。この手法を応用することで、従来から広く用いられているハイブリドーマ法では取得できなかった、難易度の高い抗体の取得に数多く成功しています。
細胞内がん抗原を標的とするT細胞受容体様抗体の効率的取得法の開発
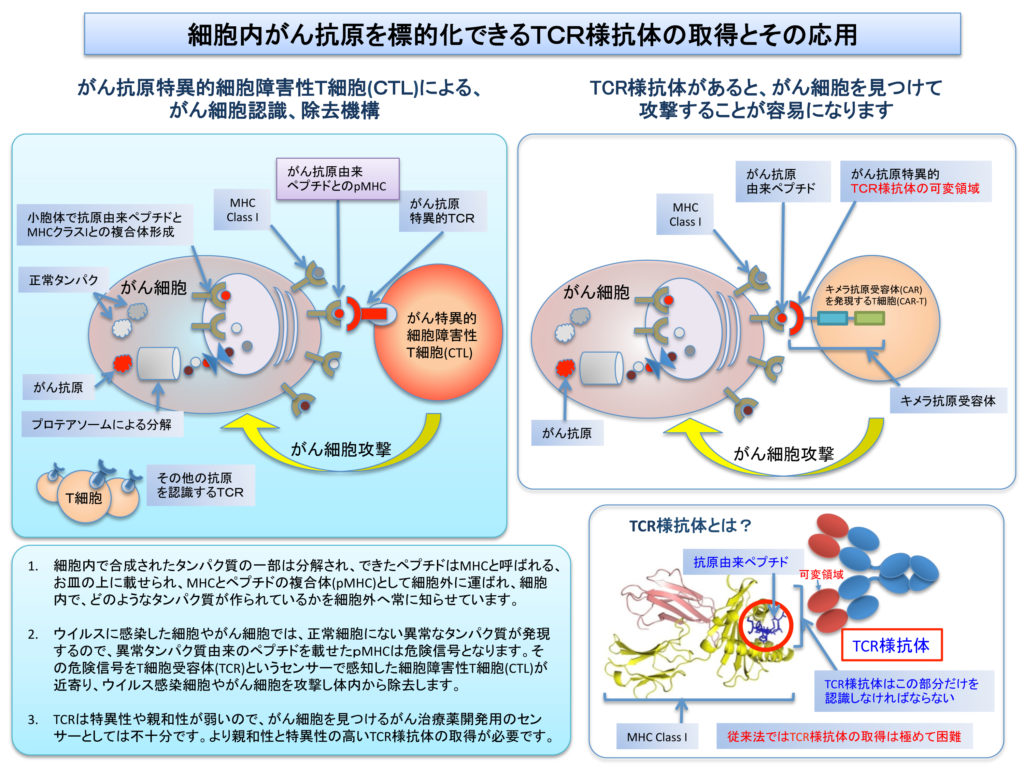
がん細胞のみで発現する「がん抗原」や、がん細胞と正常細胞で発現するものの、がん細胞で遙かに高い発現が観察される「がん関連抗原」は、体内のがん細胞を見つけて攻撃する目印となることから、がん細胞をやっつけるための治療用抗体の標的分子となってきました。しかし、これら何百種類も存在する「がん抗原」や「がん関連抗原」の大半は細胞内でしか発現せず、細胞表面における発現が認められないため、細胞膜を通り抜けられない治療用抗体にとって、標的分子として利用することができませんでした。しかし、たとえ細胞内タンパク質であっても、その一部分は抗原ペプチドとして主要組織適合抗原(MHC)クラスI分子との複合体(pMHC)を形成することで細胞表面に輸送され提示されることから、このpMHCを認識するT細胞受容体(TCR)様抗体の利用に注目が集まっています。ところが、TCR様抗体はpMHCの抗原ペプチドとMHCの両者を認識する必要があるため、従来法では取得が極めて困難でした。そこで、われわれの開発した抗体取得システムを応用したところ、さまざまな標的がん抗原に適用できる、TCR様抗体の確実かつ迅速な取得法の開発に成功しました。

磯部 正治特別研究教授
Masaharu ISOBE, Special Research Professor
略歴
富山大学薬学部卒業、富山医科薬科大学大学院博士課程修了、米国ウイスター研究所博士研究員、富山医科薬科大学和漢薬研究所助手、富山大学工学部助教授、富山大学工学部教授、富山大学大学院理工学研究部教授、現在に至る
学位・資格等
専門分野
主な業績
プロフィール
モットー 継続は力なり、やり抜くことが大事

黒澤 信幸教授
Nobuyuki KUROSAWA, Professor
略歴
富山医科薬科大学薬学部卒、富山医科薬科大学大学院博士課程修了、理化学研究所博士研究員、名古屋大学医学部助手、富山大学工学部助教授、富山大学大学院理工学研究部教授、現在に至る
学位・資格等
専門分野

札場 裕香技術職員
Yuka FUDABA, Technical Staff
略歴
静岡大学理学部生物地球環境科学科卒、静岡大学大学院修士課程生物学専攻修了
特許名 |
発明者 |
登録・出願番号 |
反応治具及び反応方法、並びにcDNAの合成方法 |
磯部正治・黒澤信幸 |
特許第5244130号 |
相同組換え方法およびクローニング方法並びにキット |
磯部正治・黒澤信幸 |
特許第5628664号 |
標的遺伝子由来配列を含む連結DNA断片の特異的作製方法 |
黒澤 信幸, 磯部 正治 |
特許第5779502号 |
形質細胞同定及び単離用蛍光プローブ並びにこのプローブを用いた形質細胞の同定又は単離方法 |
黒澤 信幸, 磯部 正治 |
特許第5779577号 |
形質細胞または形質芽細胞の選択方法、目的抗原特異的な抗体の製造方法、新規モノクローナル抗体 |
黒澤 信幸, 磯部 正治 |
特許第5963746号 |
抗原特異的モノクローナル抗体作製方法 |
黒澤 信幸, 磯部 正治 |
WO2017-026532 |