



液膜型イオン選択性電極(ISE)は,重金属イオンをはじめとする様々なイオンの濃度を連続的にモニターできる化学センサとして知られていますが,その検出下限は10-6 M程度であり排水基準レベル等の極低濃度モニタリングには適用できません。
本研究室では,ISEの検出下限がイオン選択性液膜からの測定対象イオンの漏れ出しによって支配されていることを見出し,実試料測定直前にキレート試薬溶液で液膜表面を洗浄する“リフレッシュ法”によってISEの検出下限を二桁以上向上させることが可能な高感度重金属イオンフロー分析システムを開発しました。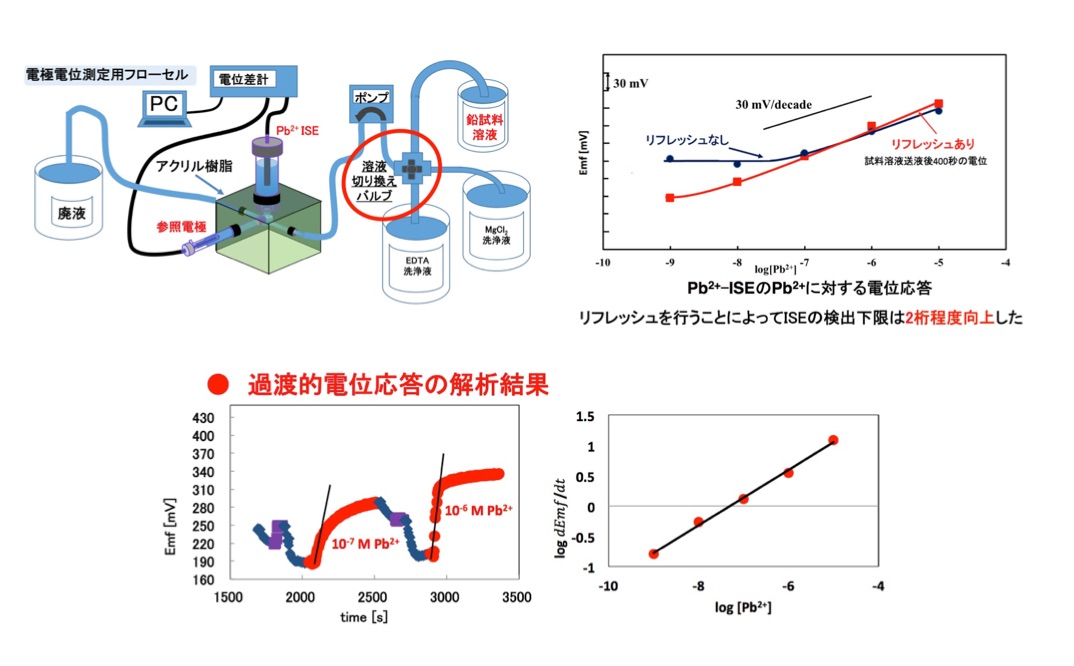
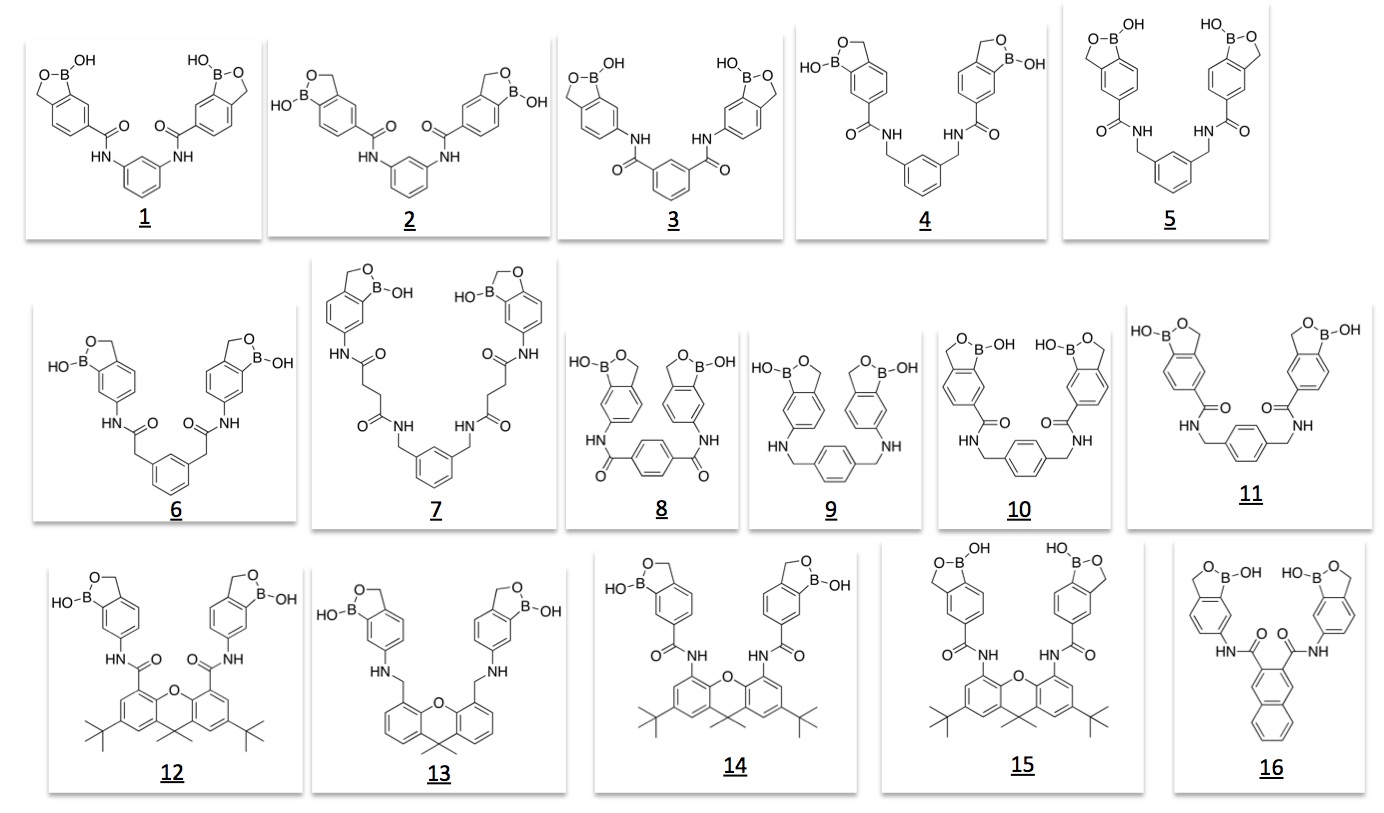
センサで血糖値を測るためには,血糖(グルコース)の形を見分けて捕まえる分子を作る必要があります。本研究室では,グルコースの6つの水酸基の内、4つの水酸基をカニのハサミで挟むように捕まえるビスベンゾボロキソール型レセプター分子の設計,合成を行い,優れた特性を有するグルコースレセプターを開発しています。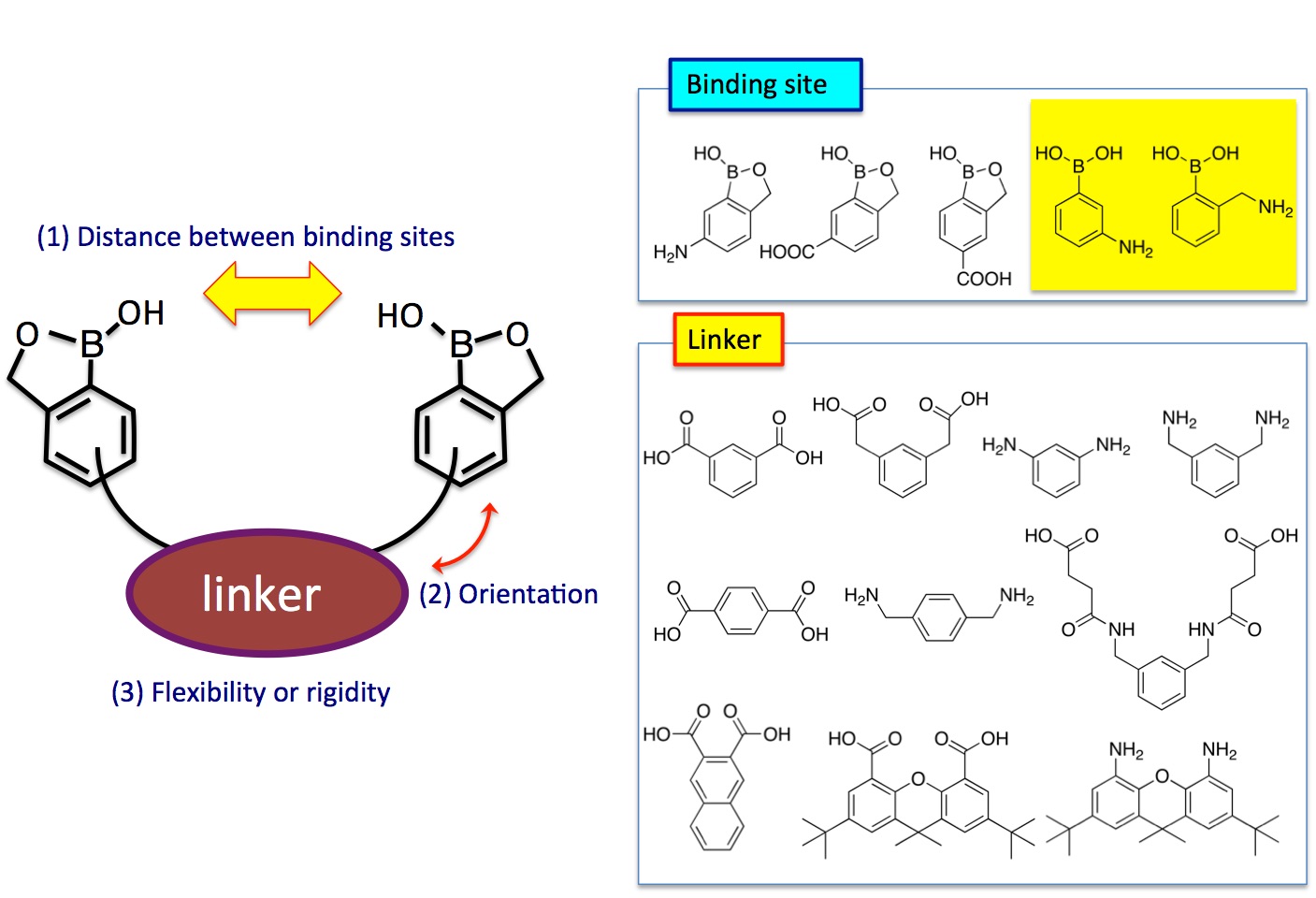
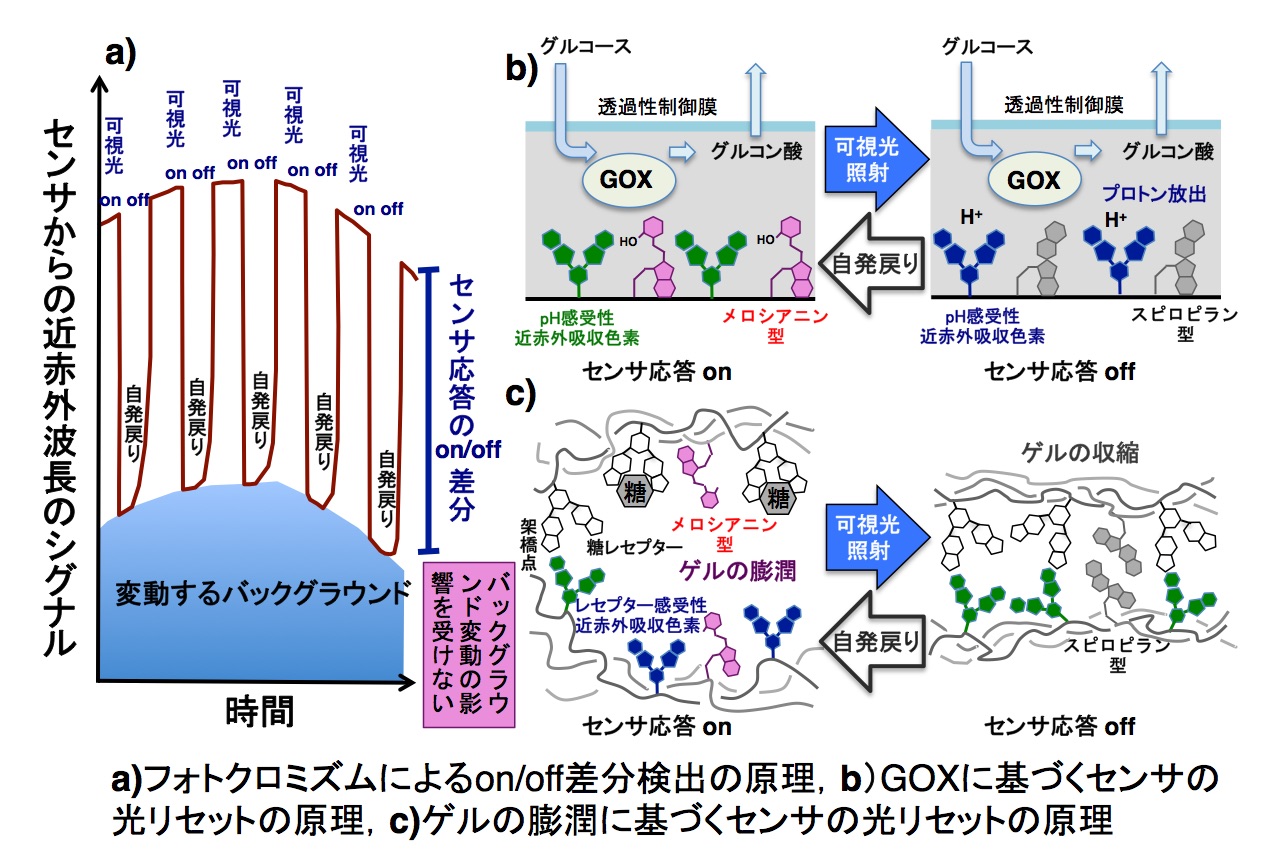
本研究室では,低浸襲的に皮下間質組織液中の血糖値をモニターできるウェアラブル光学センサの精度の向上を目指した,フォトクロミズムによる応答のon/off差分検出に基づく高精度糖センシングシステムの開発を行なっています。これは,本研究室で開発してきた近赤外吸収色素に基づくオプティカル糖センサに,可視光照射により光異性化し照射を止めると可逆的に自発戻りするスピロピランゲルを共重合によって組み込むもので,可視光照射によってゲルから放出されるプロトンあるいはゲルの収縮により糖センサが不感化されます。可視光照射を周期的に繰り返しながら,センサ応答のon/off状態での近赤外光吸収の差分を測定するかたちの,変動する迷光や皮膚組織の光学的妨害に依存しない,高精度の糖センシングシステムの開発を試みています。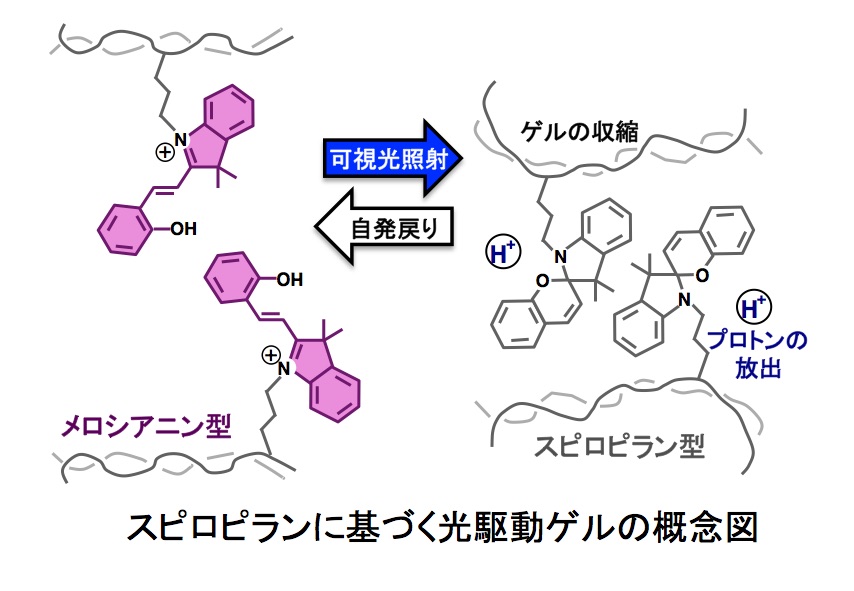
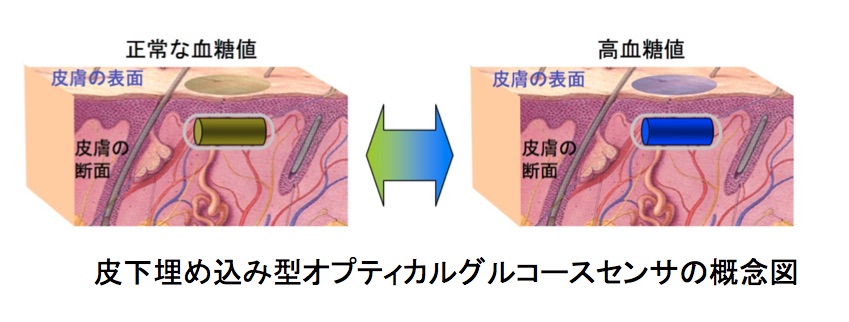
日本生活習慣病予防協会の報告によれば,平成30年の糖尿病患者及び糖尿病を強く疑われる者の数は1000万人を超えています。これらの患者さんは,血糖値管理のため指先から採血し血糖値を測定する(SMBG)必要がありますが,血糖値は食前食後で大きく変動するため,1日数回の採血による血糖値測定では高血糖状態が長時間続き,失明等の合併症のリスクが高くなります。そこで血糖値を精度よく連続的に測定できる持続血糖測定システム(CGM)の開発が長年切望されてきました。
このような糖尿病患者のニーズを受け,最近数種の持続血糖測定システムが認可され市販され始めています。しかしこれらのシステムは,グルコース(血糖)酸化酵素を固定化した針状のセンサ電極を皮膚に突き刺して用いるもので,皮膚を横切る導線のため感染症のリスクがあるとともに,一週間程度でセンサ電極を交換しなければなりません。
環境分析化学研究室では,糖尿病患者の負担がより少ない,極小型のオプティカルグルコースセンサに基づく持続血糖測定システムの開発研究に取り組んでいます。これは,グルコース(血糖)の濃度に応じて可逆的に色(光学的特性)が変化する極小型(1 mm以下)のセンサを皮膚直下の間質組織(皮膚表面から1〜2 mmの深さ)に完全に埋め込み,皮膚を介してセンサの色変化を連続的にモニターするというものです。
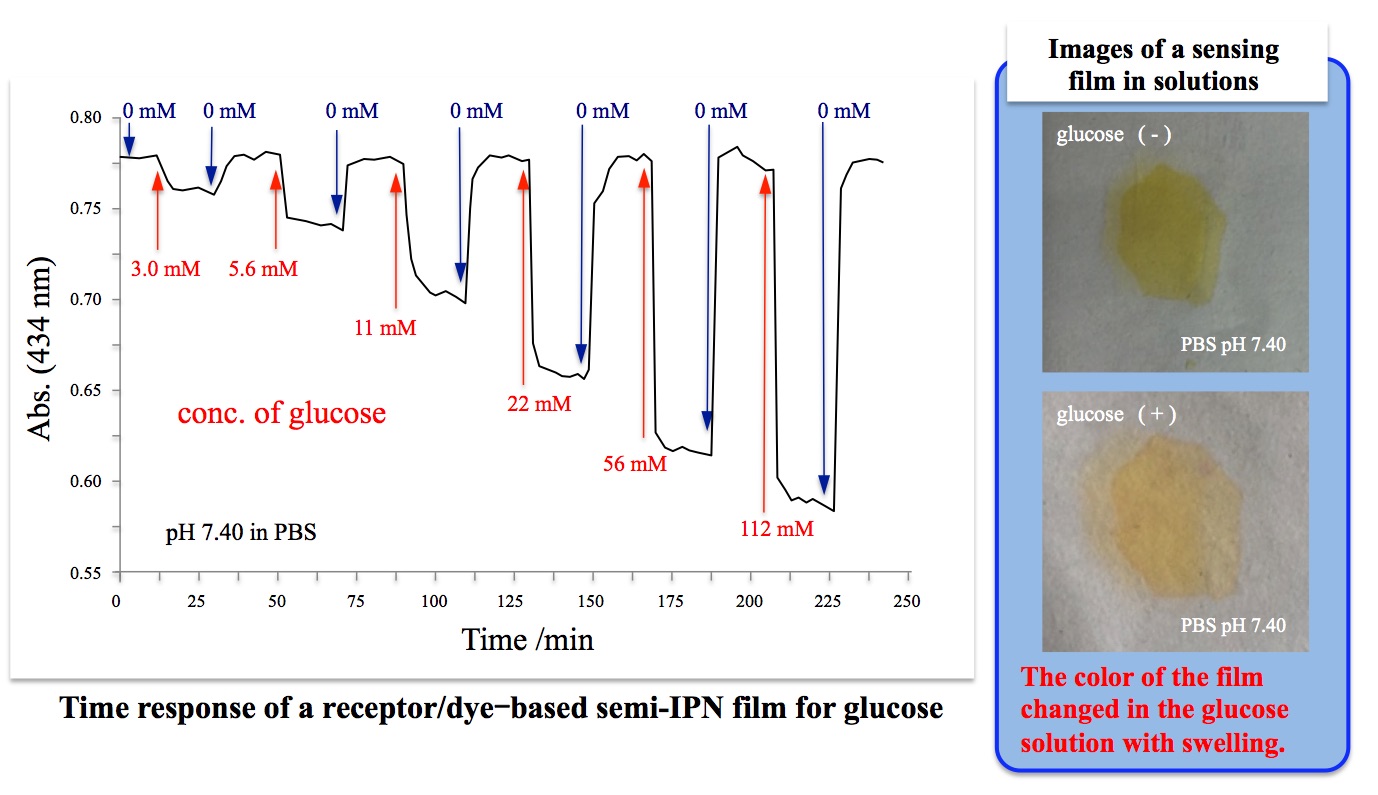
本研究室では,低侵襲的に血糖値をモニターできる皮下埋め込み型ウエアラブルセンサの構築を目指した,高分子ゲルの膨潤に基づくシグナル増幅能を有し,糖濃度に応じて迅速かつ明瞭に色が変化する,レセプター/機能性色素複合体を架橋点とした糖センシング高分子ゲルセンシングフィルムの開発を行なっています。これは,ビスベンゾボロキソール型糖レセプター及びレセプター感応性色素に重合性官能基を導入し,これらを単官能モノマーと分散/乳化共重合させることによって調製するもので,試料中の糖と高分子ゲル架橋点の固定化レセプターとの競争的錯形成に伴って固定化色素が錯解離し,高分子ゲルの色変化をもたらします。また,それと共に,高分子ゲルの架橋点の減少に伴ってゲルが膨潤し固定化レセプター/色素間の距離が増大し更なる架橋点の解離が促進され,糖に対する色変化応答が増幅されます。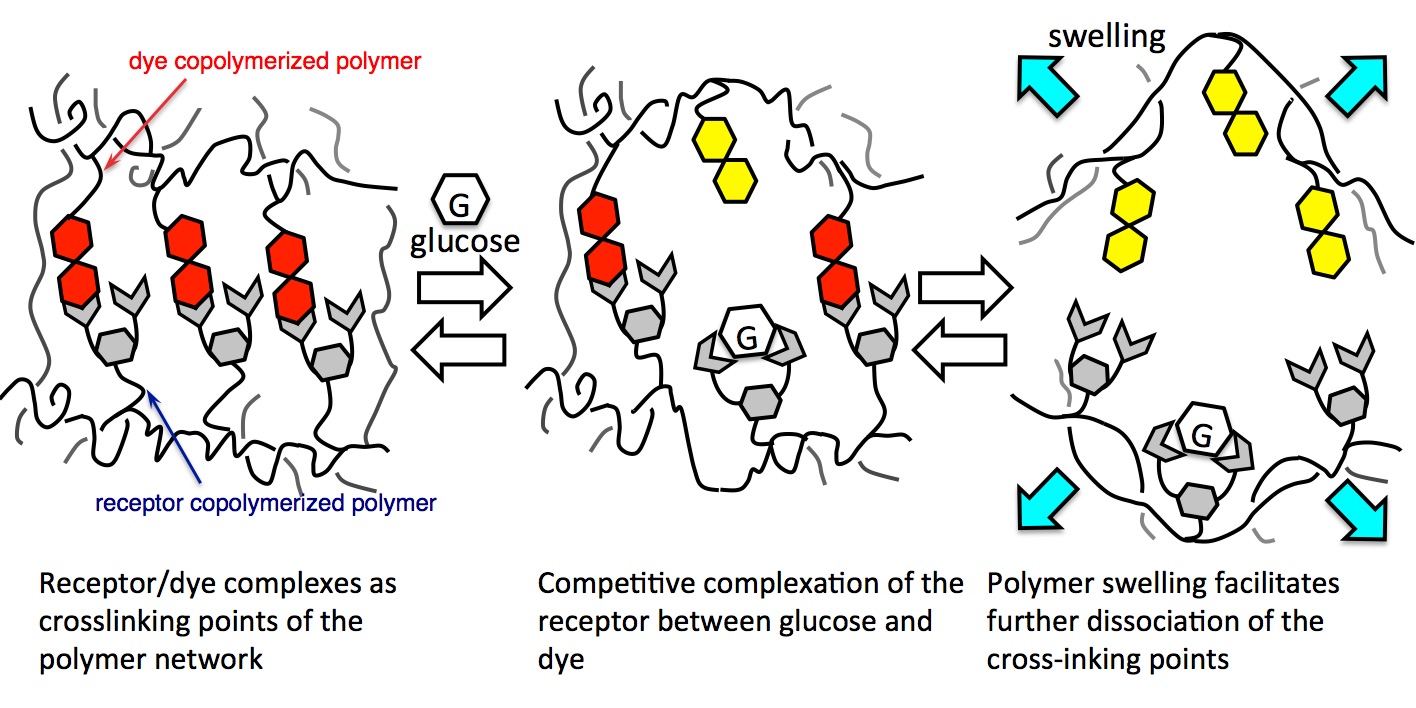
規則正しく整列した細孔を有する逆オパール構造(IOS)のポリマーに白色光を照射すると,高分子の屈折率・格子定数・観測する角度に応じて,ブラッグの法則およびスネルの法則により説明される単色の反射光(構造色)を呈します。この「構造色」の変化を利用することで,退色の恐れがない生体分子センサーを開発できないかと考えました。具体的には,標的分子の濃度に応じて可逆的に膨潤/収縮することで格子定数が変化し,結果,構造色が変わるセンサーの開発を試みています。現在,実施例として女性ホルモン(エストロゲン)を可視化検出できるセンサーフィルムの開発に取り組んでいます。本センサーの設計概念は,原理的には標的を生体分子全般に拡張可能であるので,標的生体分子に応じた高い選択性を有するカスタムメイドのセンサーとなりえます。
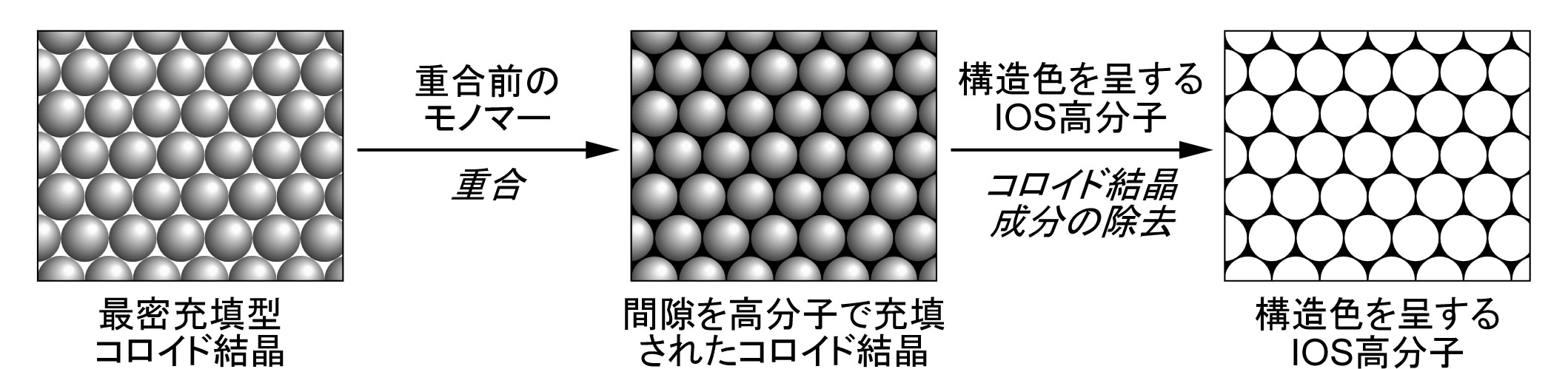
図1 IOSゲル調製法の模式図
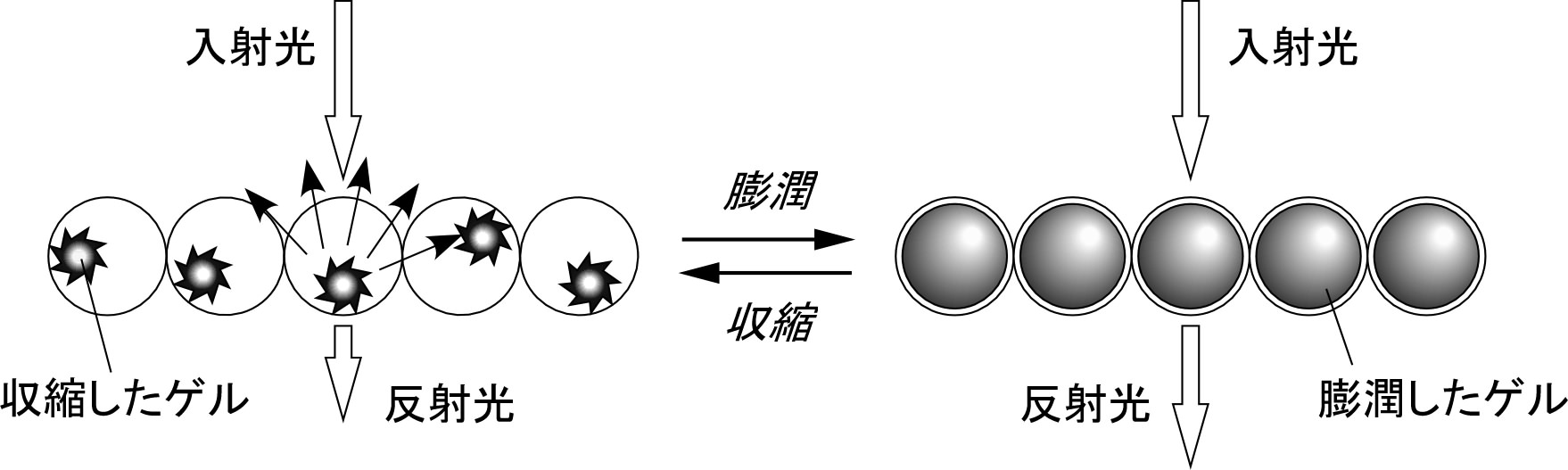
図2 構造色変化の模式図

遠田 浩司教授
Koji TOHDA, Professor
略歴
慶応義塾大学理工学部卒業,慶応義塾大学大学院理工学研究科博士課程修了,北海道大学理学部化学科助手,東京大学理学部化学科助手,米国オハイオ州Case Western Reserve University客員准教授・主席研究員,富山大学大学院理工学研究部教授,現在に至る。
学位・資格等
工学博士
専門分野
分析化学
主な業績

菅野 憲助教
Akira KANNO, Assistant Professor
略歴
東京大学理学部化学科 卒業,東京大学大学院理学系研究科化学専攻 修士課程 修了,東京大学大学院理学系研究科化学専攻 博士課程修了,東京大学大学院理学系研究科化学専攻 客員,東京大学大学院総合文化研究科広域システム科学系 産学官連携研究員,東京大学大学院理学系研究科化学専攻 助教,現在に至る。
学位・資格等
博士 (理学)
専門分野
分析化学,バイオセンサー
主な業績